
2016年7月25日取材
最初に先生の研究における現在までの道のりをお伺いしたいのですが。
どうしてこの道に進んだかというのは単純な理由で、薬を創りたかったので薬学部に進学したのです。薬学部に進学すれば当然薬を創っていると思いますよね。ところが私が薬学部に進学した40数年前は、薬学部では薬を創ってなかったんです。これは非常に不思議に思いましたね。医学部でお医者さんが患者さんを治していないようなものですから。もちろん天然化合物の薬効とか、ちょっとした創薬をやっているところはありましたけれどね(笑)。基本的には有機化学や、分子生物学であれば、理学部の化学科、あるいは生物学科とやっていることはほとんど変わらない。薬理作用を調べるのであれば、医学部の基礎医学でやっていることとほとんど変わらないという様な学部だったんですね。いつの日かは薬を創りたいなとは思っていましたが、今回この創薬等支援技術基盤プラットフォーム事業のようなプロジェクトができるまでは、やりようがないと思っていました。
え、そうなんですか。
例えば、仮に私が疾患と関係している酵素などのタンパク質を見出したとしても、その阻害剤というのは、インシリコとか構造解析とかで、予測はしましたが、今と比べるとずいぶん未成熟な段階でほとんど有効ではありませんでした。活性のある化合物は取れないのです。100個化合物を創っても「おそらく駄目でしょうね」と言われました。そうなると5年間くらい全く成果が出ないということが平気で起こりうるわけです。ですから、それはとてもテーマとしては成り立たないですよね。もうちょっと論理的に何かできればいいかなとは思いましたが、それをやるためには、スタートの時点で創薬研究を行うための基盤設備がいるんだろうなと思っていました。当時の製薬企業には私たちが今ようやく整備してきた化合物ライブラリーがすでにありましたから、製薬企業ではそれを使ってヒット化合物を出して、そこから研究がスタートするわけですよね。IC50は、はじめは1 µMとか10 µMとか弱いですけど、それを高めていくということは不可能ではありません。そのような基盤設備がない状態で、1 µMあるいは10 µMの化合物が天から降ってくるわけではないので、できないんですよね。やりようがないんです。やりたくてもできなかったなというのが正直な話でした。
薬学部が薬を創る学部ではないことは薬学部に入られてからお分かりになったのですか。
入ったとたんに、あれ薬学部って薬を創っていないんだなと思いましたね。その代わり有機化学は非常に活発に研究されている学部でした。理学部の化学科はどちらかというと化学の反応機構あるいはスペクトル関係等の研究が割と活発で、有機化合物を作るという観点から言えば薬学の方が活発でした。有機化合物を作るということに関しては、その実力は非常に高いものがありました。製薬企業で低分子の医薬品を開発するために有機化合物をつくることに関しては薬学部から行った人がやっていました。
そうしますと、先生の場合、薬学士を取られた後に製薬企業に就職されるという道もあったように思うのですが、どうして大学に残られたのでしょうか。
そうでしょうね(笑)。ただ、企業に行くつもりはないというか、研究がやりたかったというか。企業でも研究はできたかもしれませんけどね(笑)。でも、いつの日か薬は創りたいなとは思っていましたね。
では、大学院に進まれてからはどのような研究をなさってこられたのでしょうか。
私はこれまでに2つの仕事をしてきたんですね。1つは創薬に関すること、もう1つはケミカルバイオロジー関係の仕事です。ケミカルバイオロジーでは新たなイメージングプローブを開発する研究をしました。具体的には、例えば細胞の中ではある刺激に応答してカルシウムイオン濃度が増えたり、リン酸化といったことが起こりますが、そういう現象をリアルタイムで捉えることは細胞をすりつぶしたのではわからない。生命現象を蛍光顕微鏡等を使って目で見てわかる、そういったことはオートファジー現象を飢餓状態の酵母を用いて顕微鏡下で観察した大隅先生の研究でも分かるとおり、すごく重要だと考えて、ダイナミックな現象をリアルタイムで測るようにするためのプローブというものの開発をしました。具体的なプローブの開発は35-6歳の頃だったかな。
プローブといっても2種類あって1つは蛍光タンパク質を使ったもの、もう1つは私が創ったような低分子の蛍光物質を使うものですね。全部で50種類以上創ったと思いますが、これまで14種類の蛍光プローブが市販されています。
プローブは使用する立場からするといろいろなものがあると助かりますね。
そうですね。プローブを細胞の培養液中に入れればいいだけですからね。でも刺激によって出るNOを測りたい時には、他の物質で蛍光発光が起こってもいけないし、ある酵素で切れたときにだけ光る、あるいはこのリン酸化反応だけで光る、というように、厳格な特異性がある事がプローブには必要ですね。だから分子設計が必要になる。そしてそれは創薬へとつながっているのです。創薬の場合には、実際にはイメージングプローブを細胞の中に入れるのではなくて、20万化合物をスクリーニングしてヒット化合物を取ってくるときにアッセイ系に加えて、阻害とかを見る訳ですよね。この場合は阻害するとピカッと光ればいい。そのような機能があれば、スクリーニング系にも使える訳ですね。実際に蛍光プローブのおかげで非常に高い選択性がある化合物を取得できることが良くありました。
そうしますと蛍光プローブの開発をしていらっしゃるときから、創薬への応用を想定していらしたということでしょうか。
まあ、していたでしょうね(笑)。ただ、先ほど言ったようにライブラリーのような基盤がないとできないと思っていましたから。でもその基盤づくりには50億円からのお金がかかります。
そんなにかかるのですか。
そう。というのは1つの化合物を購入するのに大体1つ平均1万円くらいするんですね。そうすると20万化合物というと20万×1万ですから20億円かかりますよね。ただ、これは化合物代だけ。それに手作業で20万化合物なんて取り扱えませんから、当然化合物を溶媒に溶かして云々はすべてオートメーション化された装置で行います。それらの装置は軽く10億円はかかってしまうんですね。あと測定装置。その上にそういったものを管理しなければいけない。もちろん人件費も必要。ですから、4-50億円というプロジェクトがない限りはできない訳ですよね。
それでは、ケミカルバイオロジーでの蛍光プローブの研究ともう1つの創薬に関わる化合物スクリーニングの基盤づくりをどのようにして並行して実現なさったのでしょうか。
それは「アカデミア創薬」って皆さんが言い出したから、「アカデミア創薬にはこういうのが重要じゃないかと私は思っている」ということをしきりに言ったわけですね。384ウエルのアッセイ用のプレートの1つのウエルに化合物はほんのちょっと入っていればいいんです。10 µMとか。仮に20 mgの化合物があれば1人では使いきれないくらいの量になるんです。ですから「化合物ライブラリーを日本全国に何か所も作らなくても、1か所あれば皆さんに配れますから、日本全国誰でも使えますよ」と言ったんです。それで「いいんじゃないか」と思われたんでしょうね(笑)。
この創薬等支援技術基盤プラットフォーム事業のキーワードの1つに支援というのがあります。4-50億円というすごく膨大なお金がかかるのですが、日本中誰でも使えるんだったら「まあコストパフォーマンスはいいかな」と思われたのではないでしょうか。実際今までに大体600件くらいの依頼を受け付けましたから。基盤ができれば毎年毎年4-50億円かかるわけではないですしね。ただ、維持していくためには実際に操作する人たちもある程度人数が必要ですので、人件費を含めて年間10億円近くかかるので、額としては確かに少なくはないですが、それでも4-50億円に比べればね。
ということは、先生はアカデミアに残られて基礎研究をなさりながら、創薬のための化合物スクリーニングの実現のために、周りの人たちの意識改革をしていらしたという事でしょうか。アカデミアというと、どちらかというと実験室にこもってというイメージがあって、機が熟すといっても、誰かがそのようなアプローチをしなければ皆さんの意識はそう簡単に変わらないのではないかとも思うのですが。
うーん、そうですね。研究者は自分の基礎研究をどんどんやるっていう感じね(笑)。私は基礎研究も大好きですけど、蛍光プローブをすぐに市販したりするから、実用的な応用研究も嫌いではなかったのかもしれないですね。基礎研究も大好きですよ(笑)。でも基礎研究だけだとちょっと物足りない。
先ほど言いましたけれど、創った蛍光プローブはNOや酵素反応に特異的にピカッと光るわけですけど、そのピカッと光るのには原理があるんですね。50何種類開発したのはその原理に基づいて作ったんですよ。「こうすれば蛍光がONになったりOFFになったりする」という原理は1個しかないんです。そこにあるNOと特別に反応する官能基を組み込ませて、その原理が動くようにしたという訳ですね。だから「こうやれば絶対に光るんだよ。こういうのを組み込めよ。」ということになる訳ですね(笑)。もちろん分子設計はしますけど、原理はもともとありますから論理的に展開する事ができ、精神的には楽ですよね。闇夜に鉄砲を撃っているわけではないんですから(笑)。論理的な分子設計に基づいてアイデアが出せるようになってからは、研究テーマも出しやすいですよね。たとえ研究というものが良くわかっていない4年生にでも。そうでないと、4年生に「何でもいいから、薬を創れ」と言っても1週間で荷物をまとめて「田舎に帰ります」って帰ってしまうんではないかと思うんですよね(笑)。
そうですね。ただ、先生のなさっている基礎研究は、先生の手を離れてすぐに他の人に役立っているように思えますね。
そうですかね。私にとってはみなさんどうしてそう考えないのかなと思いますけどね(笑)。例えばすごく重要なタンパク質を見つけたとして、それががんに関係しているかもしれないとしたら、その周辺のサイエンスに自分が圧倒的に詳しいでしょうから、研究の進展する先は抗がん剤が作れないかなと思いませんか?あるいは企業にお話を持って行くとか(笑)。
なるほど。それでもアカデミアというとそういった応用の方向より原理原則の追及といったことの方に関心が向く人も多いのではないでしょうか。
そうそう。原理原則。重要なのは、他人が見出した研究成果に基づかなければ、アカデミアではだめですよ。そしてやはり自分が見出したモノでなければだめです。そうでなければ製薬企業の創薬みたいですから。それを外に「使えるよ」と言えば「すごいねえ」、「そうだろう」とこうなるんですね(笑)。それは私にとっては普通のことなんですね。「みんなそう考えないのかなあ」と思いますけどねえ(笑)。
先生は学生の頃からそのようにお考えでしたか?
いやいや。学生の時にはわからなかったですね(笑)。博士課程の2年か3年になるまではわかりませんでした。ただ、研究っていうのは何なのかということは悩みましたよね。研究が何なのかをうまく表現できないんです。頭の中が完全に高校時代の勉強、つまりは受験勉強で。中学・高校までは完全に与えられた勉強で、試験をこなしていい点を取れば「お前は頭がいい」という、そういうのが学問だと思っていた訳ですよ。でもそれって全然学問ではなくて、ただみんなが知っている、今までにわかっていることを覚えているだけ。新しいことを見出した訳では全然ないですよね。「新しいものを見出すって何なのか」というのはそれまでの教育の中に入ってなかった訳です。
そういうことを意識するのに大学院に入って2-3年はかかりましたね。「新しいことをどうやって見出すんだろう」ということに悩んだ訳です。「これ面白いよ」と言われても「その基は誰かが発見したことだよね、そうすると、それを行う事はスタートから独創的ではないし、人の研究に乗って研究を行うので、研究としては2流。それは自分はやっちゃいけないんだよな」ということになりますよね。どうやったら誰もが驚く、新しい成果が見いだせるんだろうかって悩みに悩みましたね。それで「新しいことはどうやったら見出せるか」ということをいろんな人に聞きました。その中でそれなりにこの人は研究を真剣に考えているなあと思った人が1人だけいましたね。私より10年くらい先輩なんですが、その人が「寺山修司って知ってる?」って言うんです。寺山修司という人を今の若い人知らないでしょうが、1960年後半から1980年にかけて活躍し、学生運動が華やかりし頃、多くの若者にかなり強い影響力を及ぼした劇作家、詩人で、三島由紀夫のライバルとも言われていました。その人によると、寺山修司が、色々とすごく凝って脚本を書いた時、自分としてもこれは評判を呼ぶに違いないとの考えていたものが、実際には意外と評判を呼ばなかったっていうんですね。そして、自分が半分疲れて酔っぱらってさらっと書いた時があったそうで、何の期待もしていなかったそれが、予想外にすごい評判を呼んで、他人から「寺山修司はすごい。ここはこういう伏線を引いてこうやって書いている」と本人が考えてもいないようなことを高名な評論家に言われたことがあるんだそうです。それ以来、寺山修司はあまり理屈っぽく隅から隅まで固めた脚本ではなく、人によってどのようにも解釈できるように書くようにしている、と述べたとのこと。それを聞いて、その先生は、新しいことを見つける研究テーマもある程度アバウトな方がいいのではないか、研究のテーマもがちがちに決まっているものではなくて、ある程度アバウトに出した方がいいのではないかと言ったんですね。つまり自分が考えた通りを言ったのでは、既存のわかっていることの上にちょっと足しただけで、確かに新しいことかもしれないけれど、既存のちょっとした延長に過ぎない。人が驚くようなノーベル賞を取るような成果は出てこない。新しいことは従来の延長ではなく、跳んでなければいけないんですよね。質的に変わったことというのは「えっ」と思うことから見出される訳でね。その人の答えにはある程度納得はしました。やっぱり考えている人はいるんだと思いましたし、その言葉である程度吹っ切れたということはありました。
そういえば、蛍光タンパク質で下村先生がノーベル賞を取りましたね。あの先生の書かれた本を読むとノーベル賞を取った蛍光タンパク質のGFPについてはちょぴっとしか触れられていないんです(笑)。ほとんどが彼が見つけたエクオリンの話なんです。エクオリンはカルシウムがあるとピカッと光るんですが、それは彼が見つけるまではわからなかったんです。彼はエクオリンを取ることに情熱をかけていたんですが、GFPは光を当てれば光るので単離するのは簡単なんです。だから彼は、GFPはついでに取ったと書いているんですね。エクオリンの方は何がきっかけで光るかがわからなかった。だから単離しても1度光らせたらもう光らないから使えないということだったんです。あるとき、もうすでに1回光った液を捨ててしまおうと思って「流し」に流したらぱあっと光った。それで「流しに何があったのかな」って調べて見つかったのがカルシウムだったんです。エクオリンは1回光ったものでもカルシウムを入れればまた光るんです。それがわかった途端にあっという間に研究が進展した。そこの驚きをノーベル賞の話の中に書いているんです。GFPについては4-5行だけで、ついでですよ、ついで(笑)。でもノーベル賞はGFPなんですよね。不思議ですね(笑)。
そうですね。
私が創薬で1番悩ましいのはね、創薬って阻害剤を見つけるためにスクリーニングするとか目的がカチッと決まっていて、驚くような意外な新発見は出てこないようにみえることなんですよね。でも、私はそうではないと最近は感じています。先ほど寺山修司の話をしましたけれど、アカデミアの先生が行う創薬研究は、目標としては創薬ですが、必ずしもこれに拘るわけではないのですね。創薬研究の途上において、予期せぬ事として、生命現象の解明にとって重要と予感させる知見が得られた場合には、その解明に向けた研究に舵を切ることになるでしょうね。ここ10年ほど、アカデミアで創薬研究を行ってきて感じることは、創薬研究は必ずしも多くの人達が考えているようなルーチンワークではなく、逆にその中で生命科学研究を発展させる画期的な成果、ノーベル賞クラスの成果が発見できることも夢ではないという事なのですね。創薬研究というのは、その研究の過程で予期せぬ発見が良く出てきます。アカデミアの先生の中から創薬研究の途上でそのような研究の展開が出てこないかなとも思っているんです。
ただ、創薬をやり始めてから創薬の問題点というか、誰も手を付けていない課題がある事がいくつか出てきました。1つは、先ほどからスクリーニングといっていますが、企業はスクリーニング系を開発することはありません。
そうなんですか?
そうなんですよ。アッセイ系の試薬キットが市販されていれば、企業ではそれを買ってきて行うのですね。少々具合が悪くてもアッセイ系を改良することに時間を取られるより、そのような余分な事をしないで、薬を創ることに1直線なのですね。例えばキナーゼのアッセイ用の市販の試薬は384ウエルのプレートの1ウエル分で50円くらいするんです。1ウエル50円かかるとすると20万化合物をスクリーニングしようとすると1000万円かかることになります。それほど高額の費用でも企業の人はやるでしょうね。でもアカデミアにはそれはできないんです。企業には出せてもアカデミアでは1000万円もの費用は誰にも出せない。だから1ウエル1-2円でやりたいんですよね。それでそのような系を我々は開発しましたよ、1-2円のものを。市販品は値下げしましたね(笑)。企業はそういったアッセイ系を開発することに人件費をかけて時間なんか取られたくないんです。売っているんだったら買ってきて、それでヒット化合物を見つけて、脇目を振らずにどんどん先に進めてということなんです。
アウトソーシングを利用するということなんでしょうか。
そう、アウトソーシングで全部やってしまうんですね。そこが1つのこれまで知らなかった点なんです。
それからもう1つの問題点は、これは今後10年から20年のうちに問題になるかなあと思っていることです。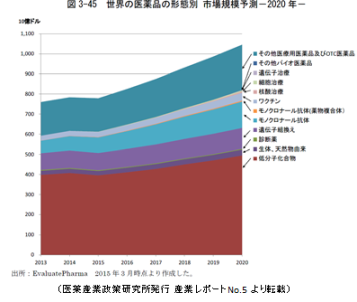 今バイオ医薬品が全盛期ですよね。企業も大きく研究所の方針を変えて、抗体医薬に大きくシフトしています。そうするとね、2020年くらいにはもう低分子の医薬品の開発がなくなってしまうように思いませんか?でもそんなことはないんですよ。右は、医薬産業政策研究所というところが出している産業レポートに載っているグラフなんですが、これによると確かにバイオ医薬品の伸びは大きいんですが、それでも1番下(エンジ色)に示されている低分子化合物も今後世界レベルでは減るのではなくてどんどん増えて行くだろうと予想されているんです。実際の売り上げはどうかというと、ワクチンやモノクローナル抗体核酸医薬といったバイオ医薬品ばかりではなくて低分子化合物も約50兆円位にまで伸びるだろう、売上げ全体の50%以上を占めると予測されている。でも今たぶん日本の製薬企業では低分子化合物の医薬品に対しては規模を縮小していますよね。
今バイオ医薬品が全盛期ですよね。企業も大きく研究所の方針を変えて、抗体医薬に大きくシフトしています。そうするとね、2020年くらいにはもう低分子の医薬品の開発がなくなってしまうように思いませんか?でもそんなことはないんですよ。右は、医薬産業政策研究所というところが出している産業レポートに載っているグラフなんですが、これによると確かにバイオ医薬品の伸びは大きいんですが、それでも1番下(エンジ色)に示されている低分子化合物も今後世界レベルでは減るのではなくてどんどん増えて行くだろうと予想されているんです。実際の売り上げはどうかというと、ワクチンやモノクローナル抗体核酸医薬といったバイオ医薬品ばかりではなくて低分子化合物も約50兆円位にまで伸びるだろう、売上げ全体の50%以上を占めると予測されている。でも今たぶん日本の製薬企業では低分子化合物の医薬品に対しては規模を縮小していますよね。
日本では研究所自体が減っているとうかがったことがありますが。
減っています。それでも2020年くらいに低分子化合物医薬品の需要がなくなるんだったらいいんですけれど、なくならないんですね。なぜかと言いますとね、特に日本においてなくならないと思う理由は、医療費の問題があるからです。国民健康保険を維持するのであれば1人数百万円の抗体医薬は使えないですよ。現在でも健康保険に使われている金額は40数兆円。半端な額ではないですよね。それが今後もっともっと増えて50兆円とかになるんですから。それに国家赤字が1053兆円を超えている。このままいくと2020年には赤字が2000兆円になってしまう。だから、なんと言ったって医療費は減らさなければならない。だから低分子化合物医薬品はなくならないんです。それに実際に先のグラフからもわかるようにこんなに多くを占めているんです(エンジ色の部分)。おそらく日本の製薬企業は低分子化合物医薬品に関しては空洞化するのではないかと思いますね。いったんなくなったらアウトですから、その時にはアカデミアがその部分を担うと思っているんです。要するに企業がやらないことをアカデミアがやるということですね。希少疾患もそうです。患者さんが世界で1000人しかいない病気のために薬を開発しても製薬会社にとってもうけがないですから。抗体医薬はもうけがあるんですよ。だって高く売れるんですから。製薬会社としては低分子化合物医薬なんか薬価が低いし、それに国の医療費のことなんて考えませんよ。自分の会社の儲けしか考えませんからね。
なるほど。ここで少し化合物スクリーニングの方に話を戻させていただきたいのですが、ライブラリーに関して、企業は実際に化合物を持っていてもその情報を外には出さないですね。
そう、おっしゃる通りです。
そうなりますと、先生が始められたような公共的なスクリーニングで提供できる化合物は、誰もが手に入れられるような化合物に限られることになるのでないですか?
その通りです。化合物の質としてはここ何年間かでかなり上がってきましたけれど、最初の時には質は全く問いませんでした。何を選ぶかは考えましたが、しょうがないので基本的には市販している化合物を使いました。それからだんだん、キナーゼやGPCRに焦点を合わせたものを集めるようになりました。しかし、今では企業からの供与化合物もかなり多くなってきました。5年前とは大きく様変わりですね。現在、4社からの化合物が入っています。
創薬機構を作って9年目になるんですが、最初の2-3年はこの機構を作るだけで精いっぱいでしたね。今になってようやく思っていたようなシステムができてきたのかなと思っています。
なるほど。まずは構想を形にするということが肝心ということなのですね。
そう。形になれば、そこにみんな付いてきますよね。製薬企業では化合物ライブラリーを持っているかどうか、また持っていてもどのくらいの化合物を持っているかもすべて秘密だったんですね。それが、私がこういうことを始めて化合物を集めたことで、企業間で化合物を交換したりするようなったんです。
私たちはライブラリーを「企業の方にもどうぞ使ってください」と言ったんです。「その代わりどのような化合物がヒットしたのかといデータは返してください」とね。製薬企業からの化合物の場合、その化合物を使うかどうかはスクリーニングをする先生が決めることなんです。それで企業からの化合物を使うということになったら、「ヒットが出たらその結果は企業に言いますけれどいいですか」ということを聞くんですね。それで「いいですよ」ということになったら、その会社から化合物の構造などのコメントをもらえるということになるんです。ですからライブラリーは創薬だけでなく何に使ってもいいんです。
先生が創薬機構を始められて製薬会社の方にも刺激を与えられたということでしょうか。
そう思います。
それでは化合物の提供以外に企業からのフィードバックというのはございますか?
アカデミアはこれまで20万化合物のスクリーニングをやったことがないので、実際にこのシステムを動かすためにはスクリーニングをやったことのある人材が重要なんです。ですから創薬機構にいる人のほとんどは企業からの出向か、企業経験者ですね。アカデミアは私ともう1人の2人だけです。私自身もやったことはなかったですから。スクリーニング講義というのは概要に関してはできても、その実際に関してはできないですね。やったことがありませんので(笑)。
他にこれを始めて何か変わったことはありますか?
こういうことを企業への外注ではなくて大学の中で始めたことで、スクリーニングのノウハウを共有できるようになりました。そうすると学生を含めて周りに浸透できるということで意味があるんです。みんな外注だと自動販売機みたいに100円入れると何をやっているかわからないけれど飲み物が出てくる、といった感じですけれど、大学内でやるということは100円を入れても途中で何をやっているかを見ることができるような感じなんですね。それを見ると色々考えて、改良しようとする。例えばもっと良いモノを作りたいと思う人が出るかもしれない、という様な感じですね。そういう意味でこのようなシステムはいいんです。
それと1番重要なのはアカデミアの先生方の意識改革かもしれません。9年前は創薬というのはアカデミアの先生方にとっては研究費を取るための方便でした。創薬という言葉が申請書や報告書の最後の2行に出てくるんですね。文章の最後に「これらの研究は創薬の役に立つ」とか言ってね(笑)。「創薬をやるために」という具合に最初に出てきてもいいのですが、そうではなかったんですね。私としては、「最後2行じゃだめだよね」って(笑)。お金を取るための方便ではなくて、本腰を入れてやってくれないかと言いたかったのですが、それがようやくこのところ意識が変わって浸透してきたかなと思っています。
今ではX線結晶構造解析だけでなくクライオ電顕の進歩はすごいですよね。私は専門家ではありませんが、そのうちに見つかった化合物がタンパク質にどのように結合しているか、なんていうことがすぐにわかったり、今から5年もしないうちにそのダイナミクスまで目に見えるようになるかもしれないですよね(笑)。それぐらい技術の進展はすごい。だから化合物ライブラリーも1つのツールとして皆さんが自由に使ってくださればいいんです。
それは先生が最初におっしゃった化合物スクリーニングということ自体がアバウトなテーマということになるかもしれないということでしょうか。
どうなるでしょうかねえ(笑)。
先生が学生の頃にもたれた薬を創る夢は、このような機構を創り上げられたことで、ある程度達成されたということでしょうか?
いやいや、そんなことはない(笑)。42.195キロのマラソンでまだ10キロくらいの所かな。それはなぜかというと、アカデミアにはまだ決定的にかけているところがあるんですね。アカデミアの先生方は活性にしか興味がないんです。でも薬は有効性だけではないのです。安全性が重要なんです。いつも言われるのは「この薬をあなたの子供に飲ませられますか?」ということなんですね。安全性が薬にとっては半分以上かもしれない。これは今やっているサイエンスとは全く違いますよね。これはアカデミアには決定的にかけています。それはどうやったらサイエンスとしてやっていけるのかなあ、ということが考えるところですね。
倫理としてならあっても、サイエンスとどう結びつけるかは難しい問題ですね。
有効性よりももっと実用の方に寄っていますから、サイエンスということになると難しいですね。
日本の医療システムには良い点が2つあって、1つは国民健康保険。これは世界に類を見ないよいシステムだと思うんですよ。医療費の問題はありますが、何とか維持していかないといけないと思っているんです。それと、薬では有害事象というのが出てくることがあるんです。その薬を飲んだら誰にでも害が出る、というのは薬害なんですが、有害事象とはそこまでいかなくて、人によって障害が出る、というもののことで、これが現在年間1400件ほどあるのです。それに対しては製薬企業からの拠出金によって、PMDA(Pharmaceuticals and Medical Devices Agency. 独立行政法人 医薬品医療機器総合機構)が救済制度というのをやっていて、年間20億円も払っているんですよ。日本の医療システムの良い点のもう1つがこの救済制度です。これがあるのは日本だけで、アメリカなんかではすぐに裁判(笑)。安全性については、本当に薬をやろうと思ったらそこを突破しないと前に進まないんですが、それを学問としてどうやって行くかということは非常に難しいです。
では大学で安全性を加味した薬を作るということが先生の次の課題ということですね。
それを1個1個ではなくて論理的にやることを考えるとアカデミアとしては難しいかもしれないですけれどね(笑)。
それでは最後に今後のプロジェクトとしてはどのようなことをお考えでしょうか。
今までお話ししてきたことが少しでも盛り込めたらいいなあと思いますね。それと京大の成宮(周)先生とも話しているのですが、たとえば非臨床レベルの動物モデルって本当にいいのがあるのかなあ、ということですね。たとえばがんの動物モデルとしてがんを植え込んだりしたものは、ある意味試験管と同じことになるので、そのために臨床実験の段階になって実際にうまくいかなかったりするのではないかと。だから今使っている動物モデルは期待するような動物モデルになっていないのではないかということなんです。本当はがんが自然発症した実験動物を用いた方がいいんでしょうけれど、実際にはできるまで長い時間をかけないといけないのでそんなには待てないですからね。それでも今後は「非臨床のヒト外挿性のよいモデル動物」が必要なのではないか、ということです。これはこのプロジェクトには欠けていることですね。もしそういうものができて、それを使った実験データがあったら、製薬会社はその化合物を喜んで買うでしょうね(笑)。
今回はたくさんの大変貴重なお話をありがとうございました。