A1-22 タンパク質中性子溶液散乱法による構造・ダイナミクス解析支援
ユニット名
構造解析ユニット
支援担当者
| 所属 |
① 京都大学 複合原子力科学研究所 量子ビーム生体高分子統合研究センター
② 京都大学 複合原子力科学研究所 量子ビーム生体高分子統合研究センター
③ 京都大学 複合原子力科学研究所 量子ビーム生体高分子統合研究センター
|
| 氏名 |
① 杉山 正明
② 井上 倫太郎
③ 守島 健
|
AMED
事業 |
課題名 |
生命科学と創薬研究に向けた相関構造解析プラットフォームによる支援と高度化 |
| 代表機関 |
理化学研究所 |
| 代表者 |
山本 雅貴 |
支援技術のキーワード
中性子小角散乱 (SANS)、中性子準弾性散乱 (QENS)、逆転コントラストマッチング (iCM)法、計算機解析
支援技術の概要
- 放射線損傷無しでの溶液散乱:中性子はX線と異なり試料に対する放射線損傷はほとんど起こさない。したがって、中性子小角散乱は放射線耐性が弱い試料の長時間測定及び経時変化を伴う試料の測定が可能である。
- 逆転コントラストマッチング中性子小角散乱測定 (iCM-SANS) :重水素化ラベリング試料を用いて、タンパク複合体中の特定ドメインや解離会合系における特定タンパク質の選択的構造解析が可能である。
- 凝集除去SANS (AUC-SANS):超遠心分析(AUC)とSANSの複合解析により、凝集の影響を排した散乱プロファイルを取得可能である。
- サイズ排除クロマトグラフィー-SANS (SEC-SANS) : 多成分溶液中の目的分子(複合体)のみを選択しSANS測定が可能である。(近日中支援開始予定:ご相談下さい)
- 準弾性中性子散乱 (QENS):ピコ秒・Åオーダーの時空間スケールのタンパク質ダイナミクス(特にタンパク質の内部運動)を計測及び解析可能である。

支援技術の利用例
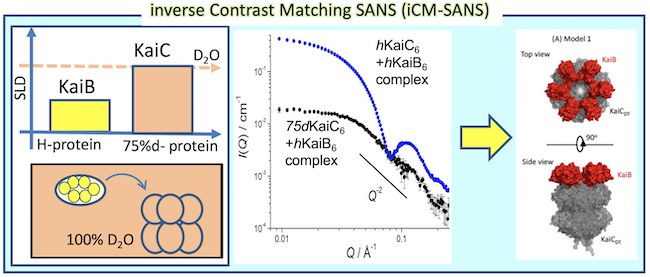
重水素化タンパク質(調製に関しては支援メニューあり)と中性子小角散乱を組み合わせることで、複合体中の特定ドメイン・サブユニットの配置構造の解析が可能となる。図に時計タンパク質KaiB-KaiCの複合体(BC複合体)中のKaiBの配置決定の例を示す。BC複合体中のKaiCを75%重水素化(75dC)し、KaiBを重水素化せず(hB)に構成したhB75dC複合体を100%重水中に溶解して中性子小角散乱を測定すると、75dCからの散乱は観測されず(散乱的に不可視化される)hBからの散乱のみが観測される(iCM-SANS法:図左)。つまりこの散乱データからBC複合体中のKaiBの構造のみが解明できる。この場合、KaiBはKaiC6量体上にドーナツ状の6量体を構成していることが判明した(図右)(M. Sugiyama, et al., Sci. Rep., 6 (2016) 35567.) また、IgGに基質が結合した際のIgGの構造変化の有無も、基質を75%重水素化した複合体を測定することで解析できる。(N. Sato, et al., J. Biochem., 169 (2021) 701.)
支援担当者の研究概要
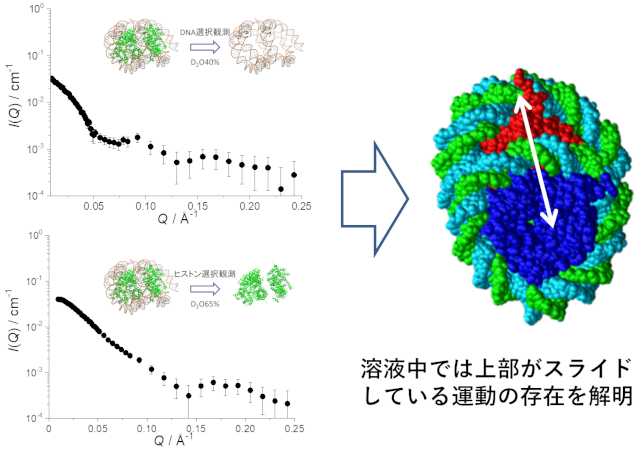
- タンパク質-核酸複合体の構造解析:Overlapping di-Nucleosome (OLDN)は、転写開始点近傍に現れるHexasomeとOctasomeからなる特異的なdi-Nucleosomeである。この溶液中での構造・ダイナミクス解析をSANS・SAXS・計算機シミュレーションを連携して行った。特にSANSでは、タンパク質と核酸は中性子に対する散乱能が著しく異なるので、溶媒の重水比率を適切に設定することでOLDN中のヒストンタンパク質 (65%重水溶媒中)・DNA (40%重水溶媒中)をそれぞれ選択的に観測することができる。これらのデータを用いることで散乱データがSAXSのみの場合より、計算機シミュレーションと組み合わせることで正確且つ詳細な構造・ダイナミクス解析を行った。(A. Matsumoto, et al, Biophys. J., 118 (2020) 2209.)
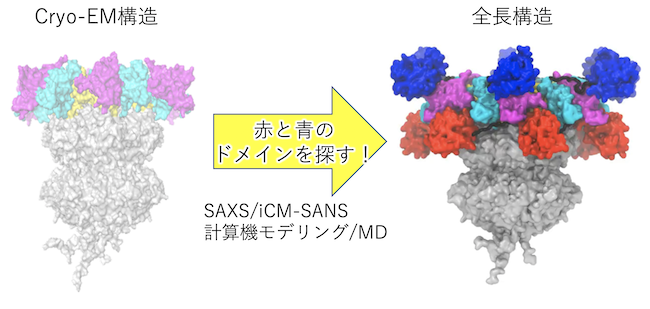
- 揺らぎを含む巨大タンパク質複合体の連携構造解析(SANS・SAXS・結晶構造解析・Cryo-EM・計算モデリング・MD simulation):近年注目される巨大タンパク質複合体は単一の手法では構造解明が困難であり、特に揺らぎ等が顕著な場合に困難さは増大する。このような場合、複数の手法を適切に組み合わせることが重要である。図に示すのは時計タンパク質が作る24個ものサブユニットからなるA12B6C6複合体の全長構造の解析例である。この例では、結晶構造解析・Cryo-EMの構造データを基に計算機モデリングを用いて20M個の候補構造を構築し、SAXS・SANSデータを満たす構造の絞り込みを行った。この際、結晶構造解析・Cryo-EMだけでは決定できなかったサブユニットの配置をiCM-SANS法による測定データが構造の絞り込みに大きく貢献した。最終的にはMD simulationを行い、散乱データを満たしつつエネルギー的にも安定な構造の抽出に成功した(図)。(Y. Yunoki, et al., Comm. Biol.,5 (2022) 184.)
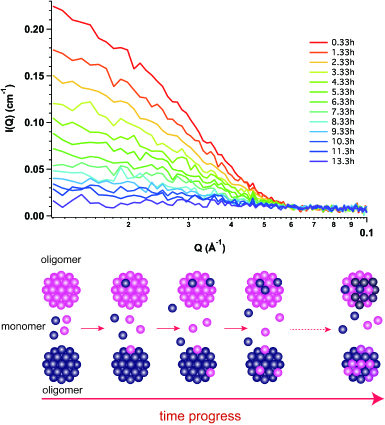
- 生体高分子のサブユニット動態の解析:水晶体の主要構成成分であるα-クリスタリンは20-40個のサブユニットから構成される会合性タンパク質として知られている。溶液中ではα-クリスタリン同士でサブユニット交換が存在することが知られていたが、その具体的な機構は解明されていなかった。そこで、軽水素化及び重水素化α-クリスタリンを調製し、それらを混合した後に時分割中性子小角散乱を行うことで溶液中でのサブユニット交換の可視化に成功した。モデル計算により、単量体のα-クリスタリンからの解離及び会合がサブユニット交換を支配していることを突き止めた。(R. Inoue, et al., Sci. Rep. 11 (2021) 02555.)
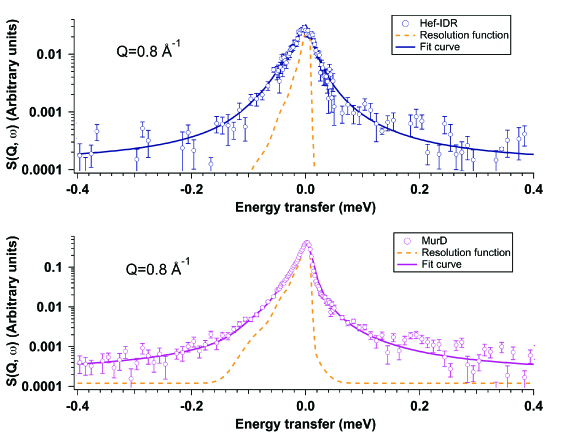
- 生体高分子のドメインダイナミクスの直接解析:蛋白質の内部運動はタンパク質の機能と深く関与していることが知られているが、内部運動をラベリングなしに直接捉える実験的手法が確立していなかった。低速中性子の有するエネルギーが蛋白質の内部運動のエネルギーとほぼ同等であることに着目し、準弾性散乱により溶液中の天然変性タンパク質 (Hef-IDR) 及びglobularタンパク質 (MurD) の内部運動を調べた。準弾性散乱プロファイルの解析から両タンパク質の内部運動の観測に成功し、更に溶媒に暴露されるアミノ酸の多寡が両タンパク質の内部運動の差異の原因であることを突き止めた。(R. Inoue, et al., Sci. Rep., 10 (2020) 21678.)