| 所属 |
① 東京大学 大学院農学生命科学研究科 ② 東京科学大学 難治疾患研究所 |
|
|---|---|---|
| 氏名 |
① 寺田 透 ② 森脇 由隆 |
|
| AMED 事業 |
課題名 | 分子シミュレーションによる生体高分子の機能の予測と解析 |
| 代表機関 | 東京大学 | |
| 代表者 | 寺田 透 | |
分子動力学(MD)シミュレーション、ダイナミクス解析、自由エネルギー地形
タンパク質の立体構造に対して、分子動力学(MD)シミュレーションを行い、立体構造の変化を追跡するとともに、立体構造分布や自由エネルギー地形の解析を行う。研究対象には、タンパク質-タンパク質、タンパク質-核酸、タンパク質-低分子化合物などの複合体構造も含む。プロトン化状態の変化や、アミノ酸置換、他の分子との結合に伴うタンパク質の立体構造変化、立体構造分布、自由エネルギー地形の変化の解析を行う。
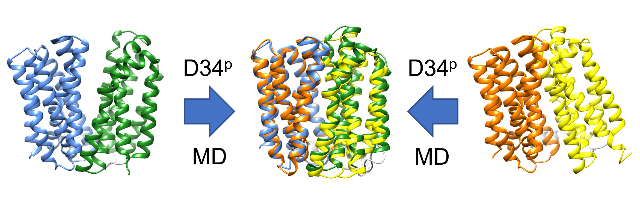
薬剤とH+の対向輸送体である多剤排出トランスポーターMdfAについて、H+輸送に伴う立体構造変化のメカニズムの解析を行った。MdfAは、N-lobe、C-lobeと呼ばれる2つのドメインからなる膜タンパク質である。これらのドメインの配向により、細胞外側が開いたoutward open構造と、細胞内側が開いたinward open構造をとる。また、outward open構造をとっている時に、pHが低い細胞外側からH+を取り込むと、inward open構造に遷移し、pHが高い細胞内側H+を放出するとともに、細胞質に存在する薬剤を取り込み、再びoutward open構造に遷移して薬剤を細胞外に放出する。本課題では、薬剤排出に重要な2つの酸性残基、E26、D34がとりうる4種類のプロトン化状態(E26-/D34-、E26p/D34-、E26-/D34p、E26p/D34p;-は脱プロトン化、pはプロトン化状態を表す)のそれぞれについて、outward open構造、inward open構造のそれぞれから出発した1~3.2 μsのMDシミュレーションを実施した。その結果、D34がプロトン化すると、outward open構造、inward open構造のいずれからも、細胞外側、細胞内側の両方が閉じたoccluded構造に移行することが示唆された [Nagarathinam et al., Nat. Commun. 9, 4005 (2018)]。
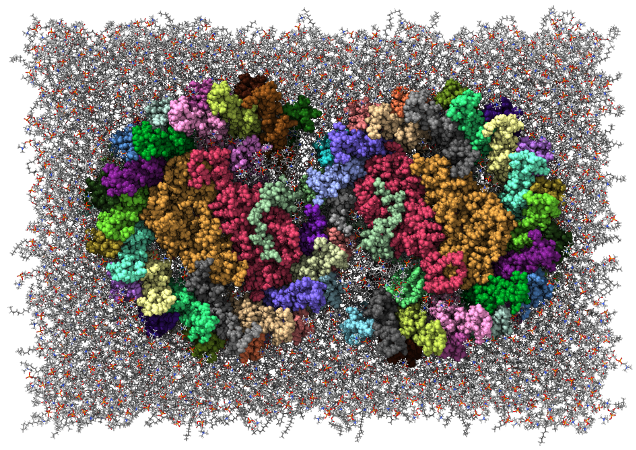
光合成細菌の光合成反応中心(RC)とアンテナ色素タンパク質複合体(LH1)が結合したRC-LH1超分子複合体について、MDシミュレーションを行い、複合体内部に結合したubiquinone-10(UQ)の運動を解析した。RC-LH1複合体は、34個のサブユニットからなり、さらに34分子のbacteriochlorophyll A、15分子のspheroidene、 3分子の1,2-distearoyl-sn-glycero-3-phosphoethanolamine、3分子のbacteriopheophytin A、6分子のUQ、1個の鉄イオンが結合している。これらを水和した脂質二重層に埋め込むことで、31万原子からなる系を構築した。この系に対し1 μsのMDシミュレーションを、初速を変えて2回実施した。その結果、複合体の外部とUQの結合部位を隔てる2本の膜貫通ヘリックスの間が広がり、そこを通ってUQが出入りしていることが示唆された [Bracun et al., Sci. Adv. 7, eabf8864 (2021)]。
また、2つのRCをLH1がS字状に取り囲むRC-LH1 2量体についてもMDシミュレーションを行った。ここでは、500 nsの全原子MDシミュレーションと、MARTINI力場を用いた5 μsの粗視化MDシミュレーションを実施し、UQのダイナミクスを解析した。電子顕微鏡構造では単量体ごとに4つのUQ結合サイト(QA、QB、Q3、QY)にそれぞれ1分子ずつUQ分子が結合していた。粗視化MDシミュレーションの結果、QYサイトに結合したUQ分子はQ3サイトに、Q3サイトに結合したQBサイトに移動して電子を受け取り、RC-LH1の外に放出されることが示唆された。また、RC-LH1からUQ分子を取り除き、RC-LH1の外部に配置した状態についてもシミュレーションを行った。この結果、S字型のLH1リングの切れ目からRC-LH1の内部にUQ分子が入り込む様子が観察された [Cao et al., Nat. Commun. 13, 1977 (2022)]。
バイオインフォマティクス、立体構造予測、分子動力学シミュレーション、量子化学計算などを駆使して、タンパク質の機能発現のメカニズムを明らかにするための研究を行っている。
研究室ホームページ:http://www.bi.a.u-tokyo.ac.jp/