| 所属 |
① 筑波大学 医学医療系生命医科学域 ② 筑波大学 医学医療系生命医科学域 ③ 産業技術総合研究所 細胞分子工学研究部門 |
|
|---|---|---|
| 氏名 |
① 広川 貴次 ② 吉野 龍ノ介 ③ 本野 千恵 |
|
| AMED 事業 |
課題名 | 標的タンパク質の構造情報を駆使した創薬分子設計技術の高度化と創薬支援 |
| 代表機関 | 筑波大学 | |
| 代表者 | 広川 貴次 | |
インシリコスクリーニング、インシリコ分子標的創薬、タンパク質立体構造モデリング、分子シミュレーション
支援課題の内容としては、①難易度の高い作用点を標的とした、インシリコスクリーニング支援研究、および②Hit to Lead支援研究とする。これまでの支援の様々なノウハウ自体を独自性と考え、効果的で難易度の高い作用点(結合パスウェイを含む)の予測と、その作用点を標的としたインシリコスクリーニングによる支援を行う(図1)。想定する標的については、国内外においても中程度の難易度の標的タンパク質のヒット率が安定してきていることを背景に、より効果的で難易度の高い作用点部位の予測と、その作用点を標的としたインシリコスクリーニングに注力している。想定される作用点としては、タンパク質-タンパク質相互作用制御部位、アロステリック部位、バイアス性制御部位、結合パスウェイ部位が挙げられる。タンパク質立体構造情報は、構造生物学実験で決定されたものに限らず、AlphaFoldモデルも活用する。Hit to Lead支援研究では、支援希望申請者がリード展開を希望する保有ヒット化合物、または、インシリコスクリーニング後のヒット化合物については、開発中の「タンパク質立体構造のダイナミクスとAIを融合したHit to Leadシステム」により、ヒット化合物からの最適化を支援する。
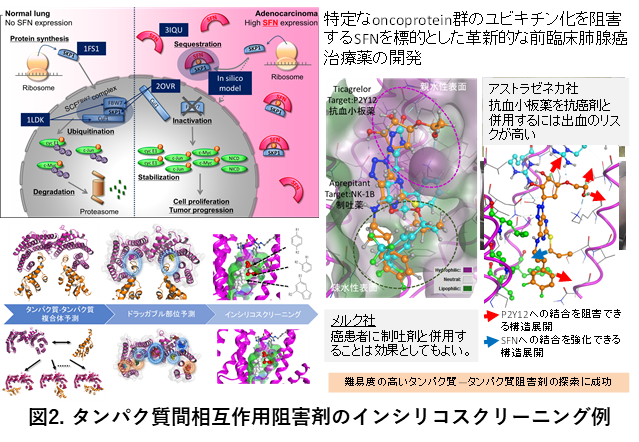
支援技術の利用例として、「Stratifinを標的とした初期肺腺癌治療薬の開発」ではタンパク質間相互作用を阻害する化合物候補2品を既存薬からインシリコスクリーニングで同定し、新しい治療薬開発に貢献した(Shiba-Ishii et al., Clin. Cancer Res., 2019)。また「EP4受容体を標的とした化合物のインシリコスクリーニング」では、既存要素技術の高度化を通じて、既知阻害薬の結合パスウェイを分子動力学(MD)計算により予測し、その解析結果をパスウェイに必要なファルマコフォアとしてドッキング計算に取り入れることでインシリコスクリーニングの精度を向上に貢献した(Toyoda Y. et al., Nat. Chem. Biol., 2019)。「in silico 創薬による転写伸長応答を制御するための薬剤開発」では、MD計算によってウィルス由来タンパク質の結合が、宿主タンパク質に新たな医薬品結合可能部位(アロステリック部位)の形成を導くことを予測した(Asamitsu K. et al., PLoS One, 2017)。またグアニン四重鎖を有する核酸の高次構造に対する化合物の結合予測および構造活性相関にも取り組み、タンパク質以外の生体高分子も支援を行った(Ma Y. et al, Org. Biomol. Chem., 2021、他)。ままた今後急増する、AlphaFold2をはじめとするモデリング構造の医薬品探索へ橋渡し技術として、MD計算によるアンサンブルとドラッガブル構造の選定にも取り組んでいる(Misawa K., J. Mol. Graph. Model., 2021)。
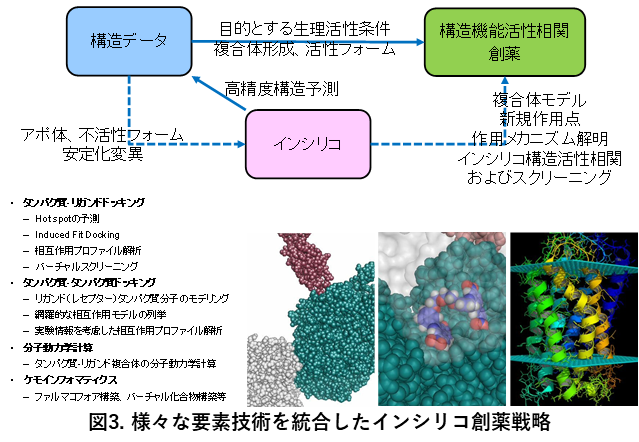
急増するゲノム配列データとタンパク質立体構造解析技術の発展により、構造生物学データを起点とした創薬支援研究が本格的に促進されている。しかし、構造生物学データの中には、特定の条件や環境に依存した構造情報により、そのままのデータでは創薬へ適用が難しいものがある。分子モデリングや分子シミュレーションは、このような問題を補完できる技術であり、構造生物データと融合させることで、より高度な創薬支援研究が実現可能となる。我々は、創薬標的タンパク質を中心に、ホモロジーモデリング、ドッキング計算(タンパク質-タンパク質、タンパク質-低分子、タンパク質-核酸、核酸-低分子)、分子動力学計算等の要素技術に基づいた分子モデリングおよびシミュレーションを融合した実用性の高いインシリコ創薬の支援研究と高度化研究を行い、構造生物学データと創薬研究の橋渡しを目指している(図3)。想定する標的については、国内外においても中程度の難易度の標的タンパク質のヒット率が安定してきていることを背景に、より効果的で難易度の高い作用点部位の予測と、その作用点を標的としたインシリコスクリーニングに注力している。想定される作用点としては、タンパク質-タンパク質相互作用制御部位、アロステリック部位、バイアス性制御部位、結合パスウェイ部位が挙げられる。タンパク質立体構造情報は、構造生物学実験で決定されたものに限らず、AlphaFoldモデルも活用する。さらに高度化研究の課題として、疾患関連変異は、機能部位近辺に集積する傾向があるという知見から、疾患関連変異をタンパク質の立体構造上でのクラスタ(3D変異クラスタ)という単位でとらえた3D変異クラスタを基点とした、未発見の機能部位探索法に取り組んでいる。このようなアプローチで新規機能部位を行った研究はこれまでに無く、新たな創薬標的の獲得が期待できる。